Phân tử 1 hợp chất gồm nguyên tử X liên kết với 4 nguyên tử H và nặng bằng nguyên tử O. Tính NTK, ho bt tên và kí hiệu của nguyên tử đó.Tính phần trăm về khối lượng nguyên tử của nguyên tố X trong hợp chất

Những câu hỏi liên quan
giúp dùm mình nha, cần gấp. thanks nhìucâu 1a/ một hợp chất có phân tử gồm 2 nguyên tử tố X liên kết với 1 nguyên tử O và nặng hơn phân tử Hidro 31 lần- Tính phân tử khối của hợp chất.- Tính nguyên tử khối của X, cho biết tên và kí hiệu của nguyên tố.b/ phân tử 1 hợp chất gồm nguyên tử nguyên tố X liên kết với 4 nguyên tử H và nặng bằng nguyên tử O - Tính nguyên tử khối, cho biết tên và kí hiệu của X.- Tính phần trăm về khối lượng của nguyên tố X trong hợp chất.c/ Phân tử 1 hợp chất gồm nguyên...
Đọc tiếp
giúp dùm mình nha, cần gấp. thanks nhìu
câu 1
a/ một hợp chất có phân tử gồm 2 nguyên tử tố X liên kết với 1 nguyên tử O và nặng hơn phân tử Hidro 31 lần
- Tính phân tử khối của hợp chất.
- Tính nguyên tử khối của X, cho biết tên và kí hiệu của nguyên tố.
b/ phân tử 1 hợp chất gồm nguyên tử nguyên tố X liên kết với 4 nguyên tử H và nặng bằng nguyên tử O
- Tính nguyên tử khối, cho biết tên và kí hiệu của X.
- Tính phần trăm về khối lượng của nguyên tố X trong hợp chất.
c/ Phân tử 1 hợp chất gồm nguyên tử nguyên tố Y liên kết với hai nguyên tử O. Nguyên tố oxi chiếm 50% về khối lượng của hợp chất.
- Tính nguyên tử khối, cho biết tên và kí hiệu hóa học của nguyên tố Y.
- Tính phân tử khối của hợp chất. Phân tử hợp chất nặng bằng nguyên tử nguyên tố nào?
Ta có :
NTK2O = 16 * 2 = 32 (đvC)
=> NGUYÊN TỬ KHỐI của hợp chất trên là :
32 : 50% = 64 (đvC)
Do trong hợp chất trên gồm nguyên tử Y liên kết với 2 nguyên tử Oxi
=> NTKhợp chất = NTKY + NTK2O
=> 64 đvC = NTKY + 32 đvC
=> NTKY = 32 đvC
=> Y là nguyên tố Lưu huỳnh ( S )
Đúng 1
Bình luận (0)
Phân tử một hợp chất gồm nguyên tử nguyên tố X liên kết với bốn nguyên tử H và nặng bằng nguyên tử O. Tính phần trăm về khối lượng của nguyên tố X trong hợp chất.
Phần trăm về khối lượng cacbon có trong C H 4 là:
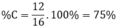
Đúng 0
Bình luận (0)
Phân tử một chất gồm một nguyên tố x liên kết với 4 nguyên tử hidro và nặng bằng 8 lần phân tử hdro. Tính nguyên tử khối , cho biết tên và kí hiệu hoá học Tính phần trăm về khối lượng của nguyên tố x trong hợp chất Mông mọi người giải nhanh hộ ạ
Gọi công thức hóa học A : XH4
Vì phân tử chất đó nặng gấp 8 lần phân tử Hiđrô nên :
\(\frac{M_A}{2.M_H}=8\)
\(\frac{M_A}{2.1}=8\)
\(\rightarrow M_A=16\)
Mặt khác :
\(M_A=M_X+4.M_H\)
\(\rightarrow M_X+4=16\)
\(M_X=12\)
\(\rightarrow X\) là Cacbon, ký hiệu là C, nguyên tử khối là 12 đvC.
\(\%X=\frac{M_X}{M_A}.100\%=\frac{12}{16}.100\%=75\%\)
Vậy ...
Đúng 0
Bình luận (3)
Ta có :
PTKH = 1 * 2 = 2 đvC
=> PTKhợp chất = 2 * 8 = 16 đvC
do hợp chất gồm nguyên tử nguyên tố X và 4 nguyên tử Hiđro
=> PTKhợp chất = NTKX + NTKH * 4
=> 16 đvC = NTKX + 4 đvC
=> NTKX = 12 đvC
=> X là nguyên tố Cacbon (C)
=> % của X trong hợp chất trên là :
12 : 16 * 100% = 75%
Đúng 0
Bình luận (0)
Theo bài XH4=8H
PTK của H2=2.1=2
=>PTK của Hợp chất =2.8=16
Ta có :PTK của hợp Chất =X + 4.H=16
-> X =12
vậy X là cacbon ,kí hiệu C
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
giúp em với ạ1.Phân tử một hợp chất gồm nguyên tử nguyên tố X liên kết với 2 nguyên tử O và nặng hơn phân tử oxi 2 lần.a)Tính phân tử khối của hợp chất Tính NTK của X, cho biết tên và KHHH?b)Tính NTK của X, cho biết tên và KHHH? 2.Phân tử của một hợp chất gồm nguyên tử nguyên tố X liên kết với 4 nguyên tử hiđro và nặng bằng nguyên tử oxi.a)Tính nguyên tử khối, cho biết tên và KHHH của nguyên tố X.b)Tính phần trăm về khối lượng của nguyên tố X trong hợp chất
Đọc tiếp
giúp em với ạ
1.Phân tử một hợp chất gồm nguyên tử nguyên tố X liên kết với 2 nguyên tử O và nặng hơn phân tử oxi 2 lần.
a)Tính phân tử khối của hợp chất Tính NTK của X, cho biết tên và KHHH?
b)Tính NTK của X, cho biết tên và KHHH?
2.Phân tử của một hợp chất gồm nguyên tử nguyên tố X liên kết với 4 nguyên tử hiđro và nặng bằng nguyên tử oxi.
a)Tính nguyên tử khối, cho biết tên và KHHH của nguyên tố X.
b)Tính phần trăm về khối lượng của nguyên tố X trong hợp chất
. Phân tử 1 hợp chất gồm nguyên tử nguyên tố X liên kết với 4 nguyên tử H và nặng bằng nguyên tử O. (Cho O =16,C=12 ; H =1)
a/ Tính phân tử khối của hợp chất.
b/ Tính nguyên tử khối, cho biết tên và kí hiệu hóa học của nguyên tố X.
c/ Lập công thức hóa học của hợp chất.
\(a,PTK_{HC}=NTK_{O}=16(đvC)\\ b,PTK_{HC}=NTK_{X}+4NTK_{H}=16(đvC)\\ \Rightarrow NTK_{X}=16-4=12(đvC)\\ \text {Vậy x là Cacbon (C)}\\ c,CTHH_{HC}:CH_4\)
Đúng 2
Bình luận (0)
Phân tử một hợp chất gồm nguyên tử nguyên tố X liên kết với bốn nguyên tử H và nặng bằng nguyên tử O. Tính nguyên tử khối, cho biết tên và kí hiệu hóa học của nguyên tố X.
Phân tử gồm 1X và 4H
Phân tử khối của hợp chất trên: X + 4 = 16.
Nguyên tử khối của X = 16 – 4 = 12đvC.
Vậy X là nguyên tố cacbon: C
Đúng 0
Bình luận (0)
Phân tử một hợp chất gồm nguyên tử nguyên tố X liên kết với bốn nguyên tử H và nặng bằng nguyên tử O. Tính nguyên tử khối, cho biết tên và kí hiệu hóa học của nguyên tố X.
Ta có: XH4 = 16
=> X + 4 = 16
=> X = 12
=> X là Cacbon (C), NTK: 12
Đúng 0
Bình luận (0)
Phân tử 1 chất gồm nguyên tử nguyên tố y liên kết vs 2 nguyên tử O. Nguyên tố O chiếm 50% về khối lượng của hợp chất.
a. Tính NTK của Y, cho biết tên và kí hiệu hóa học.
b. Tính PTK của hợp chất. PTK của hợp chất nặng bằng nguyên tử nguyên tố nào?
Hợp chất tạo nên bởi 1 nguyên tử nguyên tố Y liên kết với 2 nguyên tử O.
Do vậy hợp chất có dạng: YO2YO2
MYO2=Y+16.2=Y+32MYO2=Y+16.2=Y+32
→%mO=16.2Y+32=50%→Y=32(u)→%mO=16.2Y+32=50%→Y=32(u)
Vậy Y là S (lưu huỳnh).
Suy ra :
MSO2=32+16.2=64(u)=MCuMSO2=32+16.2=64(u)=MCu
Phân tử chất này nặng bằng nguyên tử Cu.
Ta có :
NTK2O = 16 * 2 = 32 (đvC)
=> NGUYÊN TỬ KHỐI của hợp chất trên là :
32 : 50% = 64 (đvC)
Do trong hợp chất trên gồm nguyên tử Y liên kết với 2 nguyên tử Oxi
=> NTKhợp chất = NTKY + NTK2O
=> 64 đvC = NTKY + 32 đvC
=> NTKY = 32 đvC
=> Y là nguyên tố Lưu huỳnh ( S )
Đúng 0
Bình luận (0)
mọi người ơi giúp mình với:
Một hợp chất X có phân tử khối bằng 34 gồm 1 nguyên tử X liên kết với 2 nguyên tử hidro. Hợp chất y có PTK bằng 44 gồm 2 nguyên tử y liên kết vs 1 nguyên tử oxi.
a) Tính NTK, tìm tên và kí hiệu hóa học của X và Y
b) Tính thành phần trăm theo khối lượng của các nguyên tố x và y trong từng hợp chất
a)* XH2=34
= X+2=34
=X=34-2=32
=>X lá S (lưu huỳnh)
*Y2O=44
= 2Y+ 16=44
=2Y= 44-16=28
=> Y= 14 => Y là N ( nitơ)
Đúng 0
Bình luận (1)
Câu đầu bạn đúng nhưng câu sau lại sai
Đúng 0
Bình luận (0)
Xem thêm câu trả lời






















